از تست الایزا در حالت معمول برای ردیابی آنتی ژن یا آنتی بادی استفاده می شود. بدین ترتیب كه یكی از این دو ماده در یک بستر جامد ثابت می شود و برای ردیابی دومی استفاده می شود، اما اساساً برای ردیابی هر جفت ماده ای كه مثل جفت آنتی ژن و آنتی بادی به هم گرایش داشته و قدرت اتصال مناسبی نسبت به هم داشته باشند می تواند بكار گرفته شود (مثلا لكتین به لیگاند مربوطه اش یا مولكول به گیرنده اختصاصی اش). البته این پدیده یعنی اتصال بین دو ماده ای كه آنتی بادی و آنتی ژن نیستند اما گرایش به هم دارند اغلب اوقات مشكل آفرین است و برای بالا بردن حساسیت و اختصاصی بودن اتصال بین آنتی بادی و آنتی ژن در الایزا باید این اتصالات ناخواسته را به طریقی مهار كرده و یا كارهای جبرانی لازم را در نظر گرفت.
1 ) تست الایزا برای جستجوی آنتی ژن: الایزا روش بسیار حساسی است که معمولاً برای جستجوی آنتی ژن یا آنتی بادی بکار می رود. در تحت شرایط تنظیم شده (از نظر غلظت یونی و pH) پروتئین ها (آنتی ژن یا آنتی بادی) به طور خودبخود تمایل دارند که به بستر جامد (در این تست plate هایی از جنس پلی استیرن) متصل شوند، ماهیت این اتصال بخوبی معلوم نشده است اما برگشت پذیر بوده و با استفاده از pH های بالاتر یا پایین تر و استفاده از غلظت های یونی بالا این اتصال قطع می شود. این نوع اتصال خودبخودی اگر چه ظرفیت محدودی دارد ولی با بكارگیری سیستم های تقویتی مناسبی مثل سیستم آنزیم-سوبسترا این اتصالات وسیله بسیار خوبی برای طراحی سیستم الایزا گردیده است.
برای انجام الایزا:
1 ) ابتدا باید پروتئین مورد نظر را به كف پلیت چسباند.
2 ) نقاط اتصال باقی مانده را باید با محلول پروتئینی مناسب مسدود كرد.
3 ) محلول مورد آزمایش را اضافه كرد تا دو ماده همدیگر را پیدا كرده و متصل شوند.
4 ) سیستم های تقویتی اولیه را برای افزایش حساسیت آزمایش بكار گرفت.
5 ) سیستم آنزیمی نهایی را به راه انداخته و رنگ نهایی تولید شده را اندازه گرفت.
این پنج مرحله به تفكیك در تصویر زیر توضیح داده می شوند:
1 ) اتصال پروتئین به كف پلیت (Coating): آنتی ژن (یا آنتی بادی) در مقادیری در حدود میکروگرم به داخل چاهک پلیت الایزا اضافه شده و فرصت داده می شود تا به مقدار کافی به کف چاهك (well) متصل شود برای این كار بسته به نوع پروتئین بافرهای مختلفی به كار گرفته می شود و غلظت پروتئین نیز باید مناسب سازی شود در مقادیر بسیار پایین حساسیت ردیابی پایین می آید و در مقادیر بالای آنتی ژن اتصالات سستی برقرار می شود كه در مراحل بعدی كنده شده و هنگام شستشو آنتی ژن همراه با آنتی بادی اختصاصی دفع می شوند و لذا حساسیت تست مجدداً پایین می آید.
بطور كلی این مرحله اساسی بوده و نقش زیادی در نتیجه نهایی دارد.
ایده آل های مورد انتظار برای این مرحله این ها هستند:
الف) مقدار آنتی ژن متصل شده به كف همه چاهك های یك پلیت باید یكنواخت باشند و كمترین واریانس را در نتیجه ایجاد كنند، بدین معنی كه وقتی یك نمونه واحد را در چند چاهك مختلف منتقل نموده و آزمایش كنیم باید نتایج بدست آمده به هم نزدیك بوده و حداقل خطا را نشان دهند.
همچنین اگر آزمایش مورد نظر در حجم بالا انجام می گیرد و چند پلیت را هم زمان كوت نموده و استفاده می كنیم باید جنس پلیت ها و شركت تهیه كننده آنها یكسان باشد تا از خطای مربوط به تفاوت در قدرت اتصال پلیت ها جلوگیری شود و ترجیحاً بافر كوتینگ و زمان كوتینگ و محلول آنتی ژنی آماده شده برای كوتینگ بهتر است یكسان باشند.
ب) اتصالات برقرار شده بین آنتی ژن و بستر جامد باید به اندازه كافی محكم و قوی باشند تا در مراحل شستشوی بعدی كنده نشوند، معمولاً برای آنتی ژن های عادی، اتصال دهنده اضافی لازم نیست ولی اگر آنتی ژنی استثنائاً با روش معمول به كف پلیت نچسبید یا اتصالات سستی برقرار كرد از مواد و روش های خاصی برای اتصال آنتی ژن به كف بستر استفاده می شود (مثلاً استفاده از گلوتارآلدئید یا اشعه ایكس یا …).
ج) پروتئین متصل شده نباید آنقدر كم باشد كه نتواند مقادیر بالای آنتی بادی را جذب كند در این صورت غلظت های بالای آنتی بادی قابل تشخیص نخواهد بود از طرفی پروتئین متصل شده نباید آنقدر زیاد باشد كه اتصالات غیراختصاصی از اتصالات اختصاصی بیشتر شوند كه در این صورت جواب آزمایش قابل اعتماد نخواهد بود.
برای تامین این سه هدف تمهیدات خاصی به كار گرفته می شوند كه در فرصتی مناسب توضیح داده خواهند شد.
2) مرحله مسدود سازی یا بلوكینگ (blocking): نقاطی از كف پلیت كه با پروتئین اختصاصی پوشانده نشده اند با استفاده از محلول های پروتئینی خنثی (از این نظر كه در واكنش اختصاصی بعدی اثر سوئی ندارد) پوشانده می شوند محلول های پروتئینی برای این منظور حاوی شیر کم چربی یا آلبومین گاوی یا ژلاتین و یا کازئین می باشند. علاوه بر پروتئین از دترژانت های غیر یونی خاصی نظیر Tween 20 یا Tween 80 یا … نیز به عنوان كمكی استفاده می شوند.
نوع این مواد و مقادیر بكار برده شده به صورت تجربی تعیین می شوند و با توجه به تجربیات دیگران می توان محدوده خاصی را برای كار مورد نظر امتحان كرد و بهترین غلظت را بدست آورد (چون پروتئین ها از ریشه های جانبی متفاوتی برخوردارند لذا برای پروتئین های بسیار خالص مثل پروتئین های ریكامبینانت مناسب سازی این تركیبات در بالا بردن اعتبار نتایج بسیار كمك كننده خواهد بود).
علاوه بر پروتئین و دترژانت، غلظت یونی بافر بلوك كننده نیز اهمیت زیادی دارد و برای اتصال انتخابی پروتئین مورد نظر (از میان مخلوط پروتئینی) میتوان بافرهای مختلف و غلظت یونی متفاوت را ارزیابی كرده و بهترین بافر را برای آزمایش مورد نظر بدست آورد.
3 ) اتصال آنتی ژن و آنتی بادی محلول مورد آزمایش كه احتمال می رود حاوی مقادیر قابل ردیابی از آنتی بادی بر علیه آنتی ژن اختصاصی موجود در كف پلیت می باشد در این مرحله در بافر مناسبی تهیه شده و اضافه می شود آنتی بادی شناور در محلول، آنتی ژن متصل به بستر را پیدا كرده و به آن متصل می شود. به ندرت این آنتی بادی متصل به آنزیم است اما در اغلب اوقات كونژوگه آنزیمدار در مرحله بعدی بكار گرفته می شود. آنتی بادی های متصل نشده با عمل شستشو از محیط حذف می شوند. بافر شستشو معمولا دارای پروتئین خنثی به كار گرفته شده در محلول بلوكان است. چرا؟ حاوی دترژانت می باشد. چرا؟ و از نظر قدرت و pH بافری مناسب برای اتصال آنتی ژن با آنتی بادی است. آنتی بادی ها، سرم، و محلول های بكار گرفته شده در مراحل مختلف الایزا معمولاً در بافر شستشو رقیق می شوند.
4 ) سیستم تقویتی اولیه قبل از سیستم تقویتی اصلی (كه همان بكار گرفتن خصوصیت آنزیم ها می باشد) است در این مرحله ما واكنش های اضافه تری را به كار می گیریم تا قدرت اندازه گیری تست (حساسیت و اختصاصیت) بالا برده شود. بدین منظور از قدرت تقویت كنندگی بیوتین-آویدین، بیوتین-استرپتاویدین، لكتین-لیگاند و … استفاده می شود.
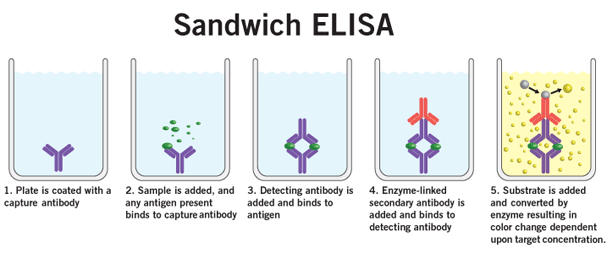
5 ) تقویت آنزیمی: هر آنزیمی بر روی سوبسترای اختصاصی خود اثر كرده و آن را به محصول تبدیل می كند. این واكنش در طی زمان منجر به جمع شدن مقدار متنابهی از محصول در محیط می شود بدین معنی كه با گذشت زمان معینی یك مولكول آنزیم می تواند مولكول های سوبسترای بسیاری را به محصول تبدیل كند این اثر افزایشی در حقیقت اساس الایزا را تشكیل می دهد. بدین ترتیب كه آنتی بادی نهایی باقی مانده پس از شستشوی نهایی با مولكول آنزیم متصل است و افزودن سوبسترا در طی زمان معینی (مثلاً یك ساعت) منجر به آزاد سازی مقادیر متنابهی سوبسترا می گردد كه یا خود رنگی می باشد یا در واكنش با ماده دیگری (كروموژن یا رنگزا) كه به محیط اضافه شده است رنگ تولید می كند در نهایت رنگ تولید شده توسط دستگاه قرائت كننده مخصوصی خوانده شده و محاسبات لازم بر روی داده های بدست آمده انجام می گیرد. اساس تست Sandwich ELISA برای اندازه گیری سیتوکین در روش الایزای ساندویچی مولكول اندازه گیری شده در واقع در بین دو مولكول مختلف آنتی بادی قرار می گیرد (ساندویچ می شود).
مثلاً این روش را در مورد اندازه گیری سایتوكاین اینترفرون گاما شرح می دهیم:
سلول های طحالی گرفته شده از موش های دریافت کننده واکسن در اثر تحریک با آنتی ژن اختصاصی در محیط کشت تکثیر پیدا خواهند کرد. برای تعیین اینکه غالب سلول های تکثیر یابنده از نوع Th1 هستند یا Th2 باید پروفیل سیتوکینی در محیط کشت مشخص شود. برای این منظور تعیین مقدار سیتوکین های IL-4 و IFN-g ترشح شده توسط سلول ها در محیط کشت مد نظر قرار می گیرد. در این روش آنتی بادی منوکلونال ضد آنتی ژن به کف plate چسبانده می شود، سپس فرصت داده می شود تا آنتی ژن (در این تحقیق سیتوکین IL-4 و IFN-g ) به آن متصل شود. در مرحله بعدی آنتی بادی پلی کلونال ضد آنتی ژن اضافه می شود که متصل به آنزیم پراكسیداز HRP است و اضافه شدن سوبسترا همراه با کروموژن منجر به ایجاد محصول رنگی م یشود که توسط دستگاه الایزا ریدر خوانده می گردد چون در این روش آنتی ژن در بین دو آنتی بادی قرار می گیرد لذا به ساندویچ مشهور شده است.